据礼来公司2025年第三季度财报显示,其旗下代谢治疗药物替尔泊肽(包括降糖版Mounjaro和减重版Zepbound)单季度销售额突破101亿美元,前三季度累计销售额达到248.37亿美元,正式超越默沙东帕博利珠单抗(Keytruda),成为全球新任“药王”。
这一更迭比市场预期提前了至少一年,不仅标志着单个药物的商业化成功,更预示着全球医药产业重心正在发生深刻变革。代谢疾病治疗领域首次登顶全球药品销售榜首,打破了肿瘤药物长期主导的格局。
一、关于替尔泊肽
替尔泊肽(Tirzepatide)是一款GIP(葡萄糖依赖性促胰岛素多肽)和 GLP-1(胰高糖素样肽-1)双受体激动剂药物。替尔泊肽针对肥胖根源发挥作用,可以减少食欲和饮食摄入。此前,替尔泊肽已获NMPA批准适用于:在饮食控制和运动基础上,接受二甲双胍和/或磺脲类药物治疗血糖仍控制不佳的成人Ⅱ型糖尿病患者;在控制饮食和增加运动基础上,初始体重指数(BMI)符合以下要求的成人的长期体重管理:≥28 kg/㎡(肥胖),或≥24 kg/㎡(超重)并伴有至少一种体重相关合并症(例如高血压、血脂异常、高血糖、阻塞性睡眠呼吸暂停、心血管疾病等)。
替尔泊肽由17种共39个氨基酸(包括37个编码氨基酸和2个非编码氨基酸)组成,替尔泊肽含有一条与司美格鲁肽结构中相似的侧链,它是由一个C20脂肪二酸通过谷氨酸和2-(2-(2-氨基乙氧基)乙氧基)乙酸二聚物,连接到侧链的赖氨酸残基上。

图1 替尔泊肽结构示意图
与司美格鲁肽不同的是,替尔泊肽在主链部分引入了两个非天然氨基酸,而司美格鲁肽在多肽主链上只引入了一个非天然氨基酸(Aib),这就导致采用生物发酵法合成替尔泊肽难度大大增加,目前的工艺基本采用固相合成法或固液联合法来完成替尔泊肽的合成。
二、生产工艺
当前,全球市场上已经问世的多肽药物超过100种,且有200种多肽药物正在进行临床试验,这些药物在免疫学、肿瘤学、心血管疾病等多个医疗领域得到了广泛应用。在这些多肽药物中,GLP-1类药物(用于治疗肥胖和Ⅱ型糖尿病)以及生长激素成为了市场上的显著代表,它们不仅证明了多肽药物领域的巨大潜力,也预示了其未来的发展趋势。
谈到GLP-1类药物的生产,生物发酵和化学合成是当前GLP-1受体激动剂药物的主要生产方式。
1生物发酵:
生物发酵是一种利用微生物(如细菌、酵母或哺乳动物细胞)生产药物的方法。在制备GLP-1受体激动剂时,可以通过基因工程技术将编码GLP-1类似物的基因插入到宿主细胞中,然后通过培养这些细胞使其表达目标肽。这些肽随后从细胞中提取并通过纯化过程得到最终产品。
生物发酵的优点包括:
可以生产与人体内GLP-1结构相似的肽;
通过选择性表达特定基因,可以生产出具有改进特性(如更长的半衰期或增强的生物活性)的GLP-1类似物;
生物系统可以进行后翻译修饰,这对于肽类药物的稳定性和生物活性至关重要。
2化学合成:
化学合成法上游主要采用多肽固相或液相合成,即通过树脂载体或在液体溶液体系下进行氨基酸偶联合成多肽。这包括使用固相肽合成(SPPS)技术,其中氨基酸逐个添加到生长中的肽链上。
化学合成的优点包括:
精确控制肽的序列和修饰,可以实现高度定制化的药物设计;
可以快速合成大量肽,适合大规模生产;
合成过程中可以引入非天然的氨基酸或化学修饰,以改善药物的稳定性、溶解性或生物利用度。
传统多肽药物的研发主要采取生物发酵法,存在着生产成本高、纯度低、稳定性差等问题。随着多肽合成技术的不断进步,现代多肽药物的研发主要依赖于人工合成。目前已上市的多肽药物多数是通过化学合成法制备,并且固相合成工艺占主导,固相合成法具有粗品收率和纯度高,研发周期短等优点,而且固相合成可以切成多个片段,分包给不同的生产服务商,从而有效地规避风险。
三、生产难点
替尔泊肽作为GIP/GLP-1双受体激动剂,在分子设计上引入了两个非天然氨基酸(D-Ala和N-Me-Ile),这一结构特征显著区别于司美格鲁肽(Semaglutide)仅含一个非天然氨基酸(Aib)的设计。这种差异直接导致其生产工艺的复杂性大幅提升,尤其是在生物发酵法的应用上面临多重技术瓶颈,迫使当前工业化生产主要依赖化学合成路径。
1生物发酵法的局限性
生物发酵法通过重组微生物(如大肠杆菌或CHO细胞)合成目标多肽,但其对非天然氨基酸的兼容性存在天然缺陷:
基因编码限制:
天然氨基酸由20种标准密码子编码,而非天然氨基酸需通过人工改造宿主细胞的遗传系统(如引入正交tRNA/氨酰-tRNA合成酶对)。替尔泊肽需同时表达两种非天然氨基酸,这对菌株工程化改造提出极高要求;相比之下,司美格鲁肽仅需引入Aib,发酵法适配性更高。
翻译效率与产物纯度:
非天然氨基酸的掺入会降低宿主细胞的翻译效率,并可能引发肽链折叠异常或错误连接。例如,D-Ala的引入需通过酶促动力学控制实现手性反转,而N-Me-Ile的甲基化修饰则需依赖额外的甲基转移酶,这些步骤延长工艺周期并增加杂质风险(如未修饰的天然氨基酸片段)。
规模化生产的经济性:
发酵法依赖高产率的细胞工厂,但替尔泊肽的复杂结构使其难以通过传统工艺实现稳定放大。替尔泊肽是一个含有39个氨基酸的线性肽。在固相合成中,随着肽链的延长,即使每一步偶联效率达到99.5%,最终全长序列的理论收率也会急剧下降。任何一步反应的微小瑕疵都会在最终产物中累积、放大。
2化学合成路径的挑战
当前,替尔泊肽的工业化生产主要采用固相合成(SPPS)与液相合成(LPPS)结合的混合策略,通过分段合成关键片段并高效偶联以平衡产率与纯度。然而,这一路径仍面临以下核心难点:
片段选择与连接效率:
替尔泊肽总长39个氨基酸,需拆分为4–5个片段(如AA1–14、AA15–21)。片段过短虽可提升单片段纯度(>99%),但增加LPPS偶联步骤(每步产率约70–80%),导致整体收率骤降;片段过长则可能因折叠困难或副反应增多而降低纯度。
C末端差向异构风险:
液相偶联过程中,片段C末端的酰胺键易发生α-立体中心差向异构化(尤其在Fmoc保护基体系中)。例如,替尔泊肽的C末端片段(AA30–39)因含D-Ala,偶联时需严格控制温度(<5℃)与反应时间(4–6小时),并采用HATU等高效缩合剂以降低异构体生成。
D-Ala的引入:
需通过化学合成法实现手性反转,通常采用Sharpless不对称环氧化或酶促动力学拆分策略。此过程需额外引入保护基团(如Boc或Fmoc),并在片段偶联前完成去保护,增加工艺步骤与杂质控制难度。
N-Me-Ile的合成:
甲基化修饰需在侧链引入甲基化试剂(如碘甲烷或硫酸二甲酯),但其强碱性条件可能破坏肽链主链的酰胺键,导致脱酰胺化副产物。因此,该修饰通常在片段合成后期进行,并需采用温和的甲基化条件(如低温、限量化合物)。
替尔泊肽的两个非天然氨基酸设计,在赋予其卓越疗效的同时,也将其生产工艺推向了一个新的高度。这不仅是简单的步骤增加,更是从相对“生物友好”的发酵模式,向高难度、高控制的“精密化学合成”模式的根本性转变。未来,半合成法(发酵+化学修饰)、连续流合成技术有望进一步优化替尔泊肽的生产效率与质量一致性,为双靶点多肽药物的广泛应用奠定基础。
四、纯化案例分享
替尔泊肽的合成主要采用固相合成(SPPS)与液相合成(LPPS)相结合的策略,兼顾效率与纯度。
1固相/液相联合合成法
礼来公司开发的替尔泊肽,就是通过固相合成法合成多个短肽片段(AA1-14、AA15-21、AA22-29和AA30-39片段)。再通过液相合成方法将上述四个片段结合得到最终产物。而合成这些短肽片段的固相合成过程中,并非是一个一个氨基酸偶联完成,而是通过带有Fmoc或Boc保护的二肽或四肽进行偶联得到多个长片段。这样做可以减少氨基酸的使用量,同时减少杂质的生成,提高生产效率和产品质量。
2固相合成法
使用Rink酰胺树脂作为固相载体,逐步偶联氨基酸。例如,首先固定Fmoc-Ser(tBu)-OH,依次脱保护(哌啶/DMF)和偶联(HOBt/DIC活化羧基),直至完成目标序列。
合成结束后,用三氟乙酸(TFA)裂解树脂并去除侧链保护基,获得粗肽。

图2 替尔泊肽生产工艺流程
多肽合成过程的相关杂质主要分为以下4类:
(1)合成过程中带入的工艺杂质,缺失肽,断裂肽,插入肽,未脱保护肽等肽类相关物质;
(2)降解杂质:多肽脱酰胺,氧化,还原,水解,二硫键错配,β-消除不稳定因素而产生的降解杂质;
(3)聚合物:二聚体及多聚体;
(4)光学杂质:消旋化,非对映异构体杂质。
这些杂质可以在合成或纯化过程中进行控制或去除,影响多肽纯化的因素有:
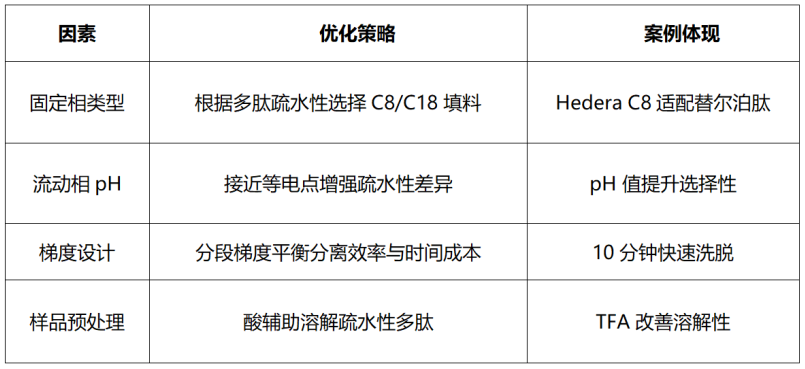
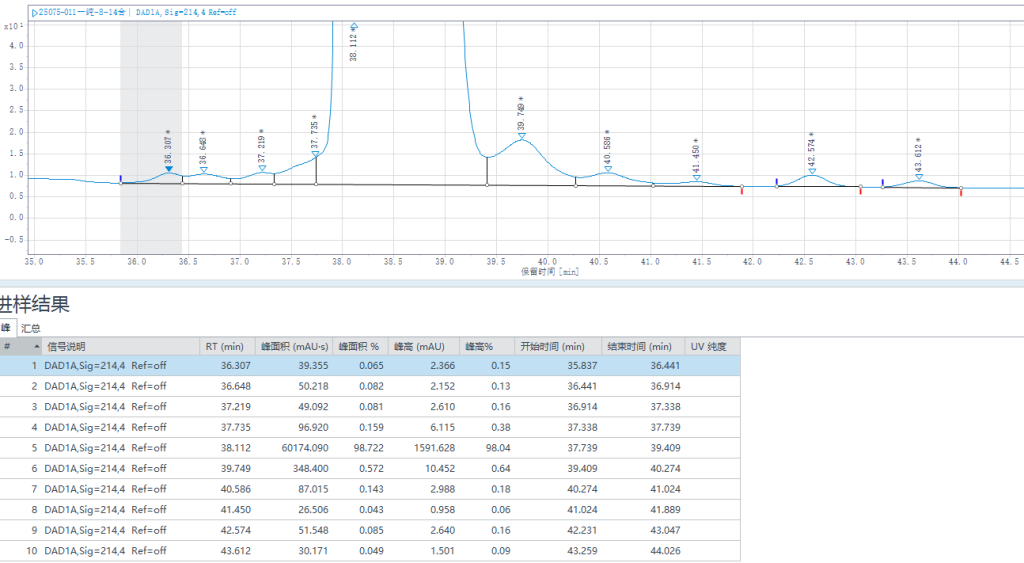
江苏汉邦科技股份有限公司应用技术团队在对替尔泊肽样品进行分离纯化时,针对替尔泊肽的复杂杂质谱(包括未偶联片段、差向异构体、脱酰胺化产物等),通过两步高压纯化的方式,成功将样品纯度提升至99%以上。
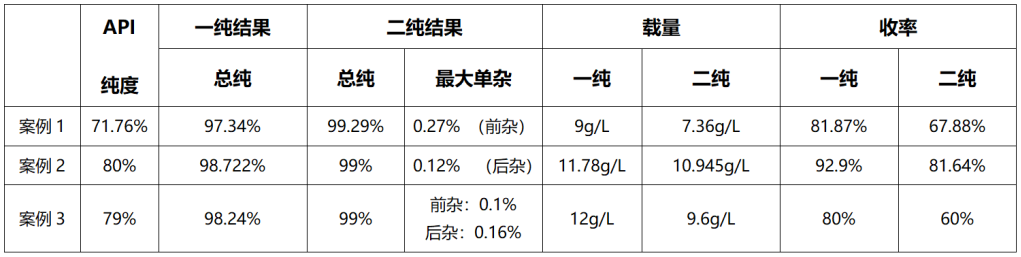
汉邦科技替尔泊肽小试纯化数据
纯化案例分享:
色谱柱:10×250mm
填料:Hedera C8
洗脱方法:
上样量:235.64mg(折纯)
制备谱图--
—纯制备谱图:
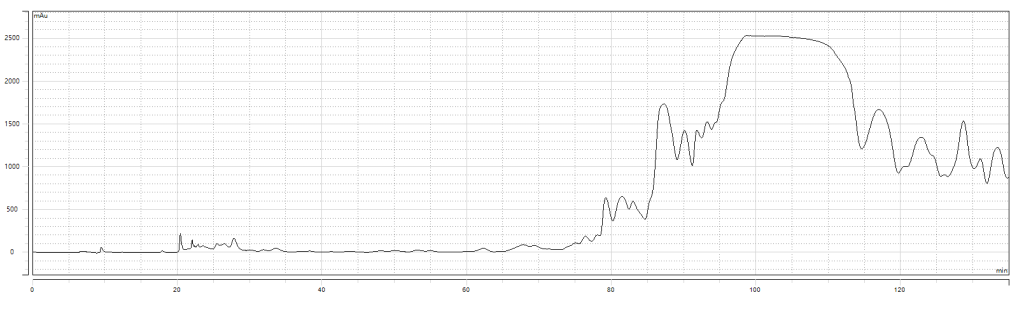
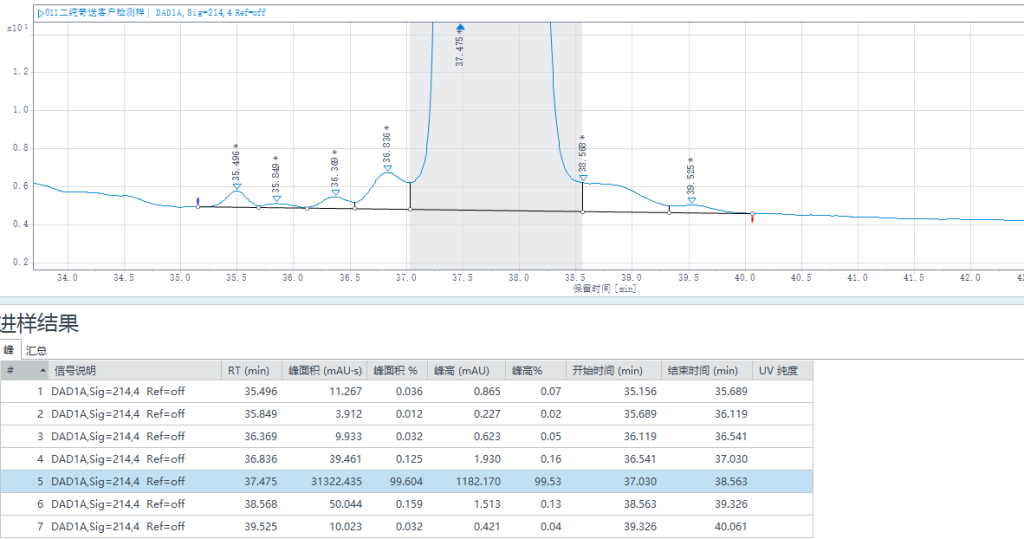
一纯检测结果:纯度98.722%,收率92.90%。
二纯制备谱图:
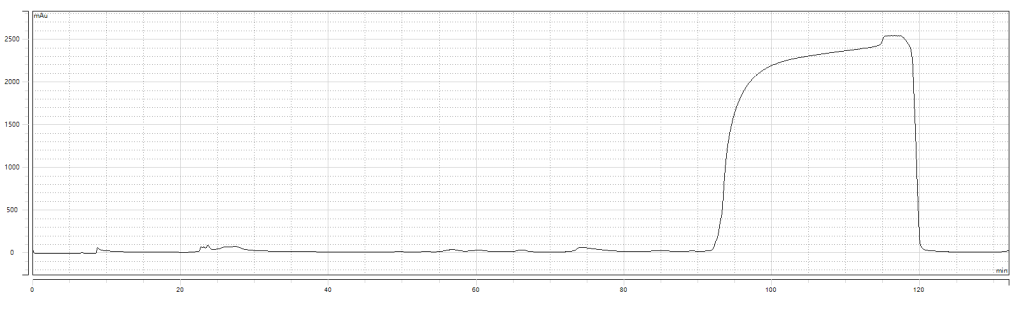
二纯检测结果:纯度99.604%,收率81.64%。