背景
寡核酸药物是一类创新性的治疗方法,其作用机制独特而强大。这些药物通过干预基因转录和翻译过程,能够从根本上调控致病基因的表达,从而达到治疗效果。寡核酸药物是目前发展最为迅速的基因疗法之一,一般是由12~30个核苷酸单链或双链组成的一类药物,通过直接靶向致病靶基因或作用于信使RNA(mRNA)来调控致病基因转录翻译,具有高特异性,通常采用固相亚磷酰胺化学法来进行合成。
在寡核酸药物的合成过程中,包括磷酸骨架、糖环、碱基在内的众多点位均有可能产生不同类型的副反应,同时受到合成效率以及原料质量等的影响,导致粗品中含有多种不同的杂质,最难控制的一类杂质是由于单个或多个核酸单体差异导致的失败序列(N-x/N+y)。这些N-x与N+y杂质的性质与目标产物非常接近,在分子大小、电荷和疏水性方面的差异通常很小,为后续的纯化工艺带来巨大的挑战,合成后必须采用高分辨率纯化技术,才能使目标分子与杂质分离。
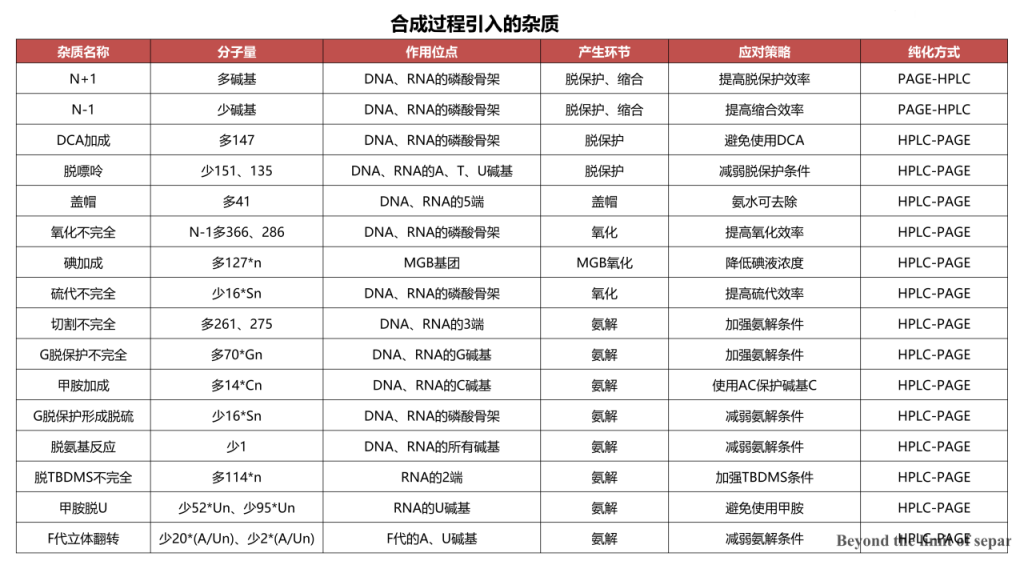
寡核苷酸药物的纯化工艺挑战
层析步骤是控制产品相关杂质的关键工艺步骤,而层析工艺开发的核心在于掌握并利用不同类型杂质与药物活性成分 (API) 的性质差异,常见的可能影响样品层析行为的性质差异主要包括以下几类:
带电基团:寡核酸所带静电荷取决于磷酸或修饰基团的数目,碱基的数目以及二级结构是否遮蔽带电基团;通常在变性条件(例pH12)打开氢键使结构展开并且碱基不带电(pH>pKa),以有效区分N-1杂质。
DMT on/off:DMT是一个强疏水性基团,与反相层析/疏水层析产生相互作用。因此可以用于带有DMT的全长序列的分离。
硫醇化 (Thiolation):当磷酸基团中的氧原子被硫原子取代时,带负电的基团极性增加,在大多数 pH 条件下与阴离子交换填料结合更强。
甲基化(Methylation):当氧原子被甲基取代时,疏水性增强。
脱嘌呤 (Depurination):过度的酸性暴露会导致嘌呤碱基与脱氧核糖之间的断裂,在一定 pH 条件下会改变分子电荷与疏水性。
因此,寡核酸药物的层析纯化,实际上主要依赖的是API 与 PRI 分子之间电荷与非极性基团的数量差异。根据合成结束后是否保留 DMT 基团以及是否选择柱上脱保护,通常采用离子交换层析层析或反相制备色谱进行纯化。
一离子交换层析:
阴离子交换层析(AIEX)是一种可以在水性条件下对寡核苷酸进行分离的实验方法,无需使用高成本含有机溶剂洗脱液,也无需对车间和设备进行防爆设计,特别适合用于纯化寡核苷酸。其中应用最广泛的填料是15Q/30Q(汉邦全资子公司汉德科技的HB-POR15Q),基架材质为聚苯乙烯,粒径15/30 μm,操作空间大,载量高,变性条件(pH 12)下依然可对寡核苷酸样品进行纯化操作,避免了单链自互补或者富含GC碱基的寡核苷酸聚集。
和蛋白类样品纯化相似,寡合苷酸的纯化工艺需要考虑多种因素的影响,例如纯化缓冲液pH和盐离子浓度、载量、流速、操作压力、柱床高度、以及操作温度等。需要根据样品是否脱去最后一个DMT基团以及寡核苷酸长度来调整洗脱盐离子浓度和洗脱体积。

Bio-lab 实验室级层析系统
1.1 纯化缓冲液pH和盐离子浓度
纯化缓冲液pH和盐离子浓度是目标分子洗脱的重要因素之一,高pH洗脱剂的一个重要用途是控制单链自互补或者高GC条件下形成氢键聚集。大多数相互作用在pH 12时可以被打开,但是RNA在强碱性条件下不稳定,需在近中性或弱碱性环境下进行纯化。
如果考虑到后期的工业放大,必须摸索最佳的高盐洗脱比例,建议低于2M,并且洗脱的时间不能高于0.5h,氯离子浓度过高,会对不锈钢材质具有一定腐蚀性。
1.2 样品载量、保留时间和装柱高度
寡核苷酸分子量低,电荷和疏水基团相对较少,可以适当调整保留时间和载量,达到更好的分离效果,对于比较有挑战性的项目,可适当降低上样量以保证分离纯度,这主要是由于随着上样量的降低,杂质峰和主峰的峰面积在减小的同时两者的交叠区也在减小,在进行组分收集时有利于提高单管纯度。
柱高的增加也有助于提高分辨率,考虑到细粒径填料可能带来的压力问题,同时柱高的增加也会影响工业放大过程中填料的用量增多,导致成本增加,通常情况下装填高度范围在15-20cm左右。
1.3 纯化温度
纯化温度是具有挑战性的参数之一,不同样品热稳定性存在差异。一般室温条件下即可达到很好的纯化效果,但有时也需要对纯化温度进行优化。此外,保证整个纯化环境温度的一致也很重要。
二反相制备液相色谱:
反相制备液相色谱(Preparative Reverse Phase Liquid Chromatography, Prep-RPLC)是一种基于溶质在极性流动相和非极性固定相之间的分配差异,通过精确检测并收集相应的馏分来实现物质分离纯化的技术。在这项技术中,固定相通常采用非极性键合相填料,如C18、C8烷基链键合的硅胶,而流动相则由极性有机溶剂(如甲醇、乙腈)和水按一定比例组成。
RP-HPLC 利用固相中的疏水性可以很好的结合含有5’-DMT的寡核苷酸,没有DMT保护的核苷酸杂质由于结合力比较弱,可以被先洗脱下来,含5’-DMT的寡核苷酸用较强的溶剂洗脱下来,最后去除5’-DMT,做到很好的分离。

实验室级制备液相色谱系统
2.1 色谱柱选择
需选用高耐压、高稳定性的反相色谱柱(装填C18填料),以应对大规模生产中的压力波动和长期使用需求,主要考虑填料的上样量,分离度和回收率等之间平衡。
2.2 流动相的优化
通常采用乙腈-水体系,并添加少量酸(如0.1%甲酸)以抑制硅胶表面硅羟基的干扰,提升峰形对称性。
在流动相中加入离子对试剂(如三乙胺乙酸盐,六氟异丙醇),并控制流动相pH(如7.0-8.0)以稳定离子对复合物,其疏水端与寡核苷酸磷酸骨架结合,亲水端溶于水相,使原本亲水的寡核苷酸转化为疏水复合物,从而增强其在反相色谱柱上的保留能力。
2.3 工艺放大挑战
实验室级别工艺开发后,需通过线性放大至工业化规模,要平衡上样量、收率、纯度和成本等因素。
寡核苷酸药物的纯化案例
一样品1:

1.1 纯化方法
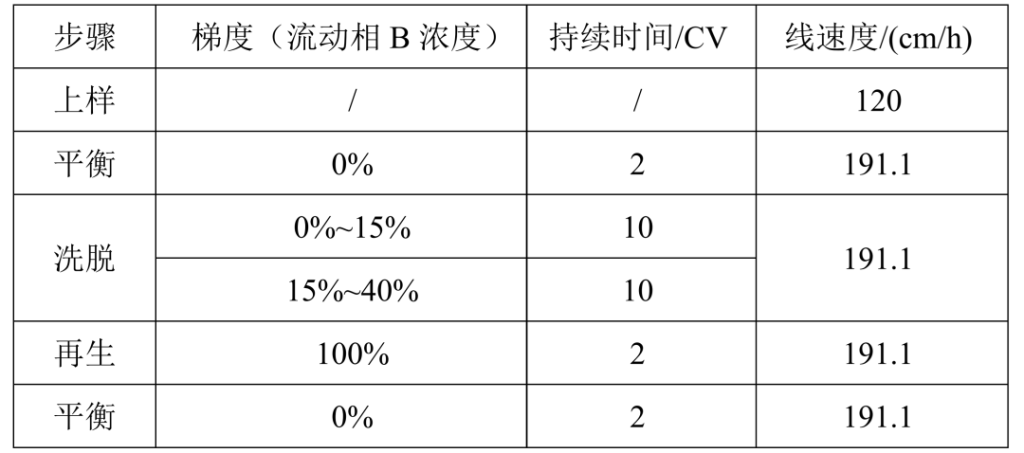
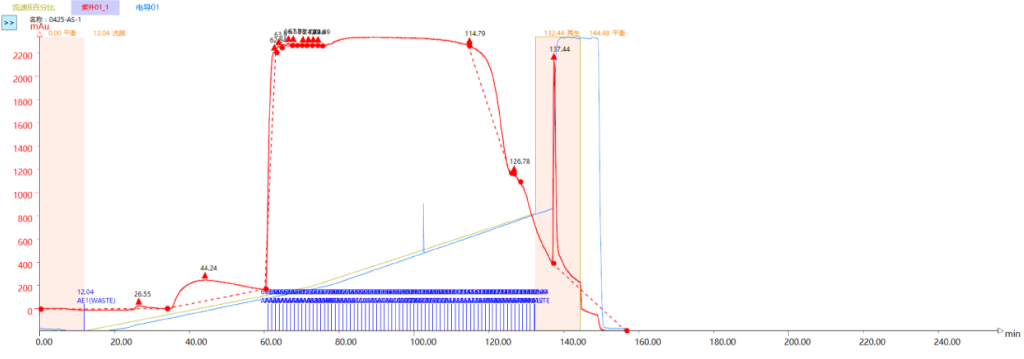
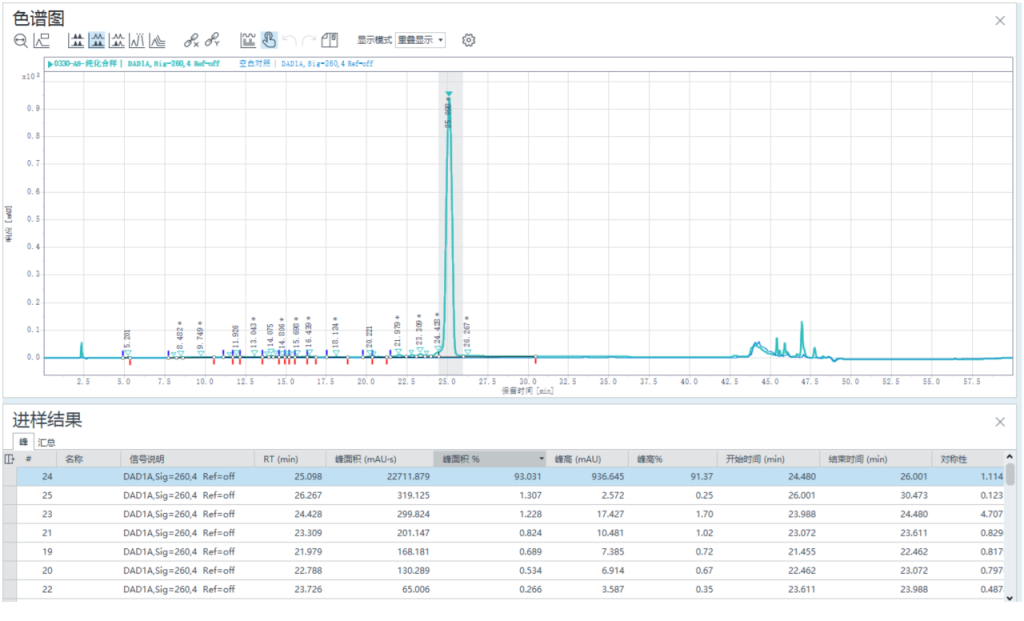
合样检测纯度93.031%,样品收率:81.3%。
二样品2:

2.1 纯化方法
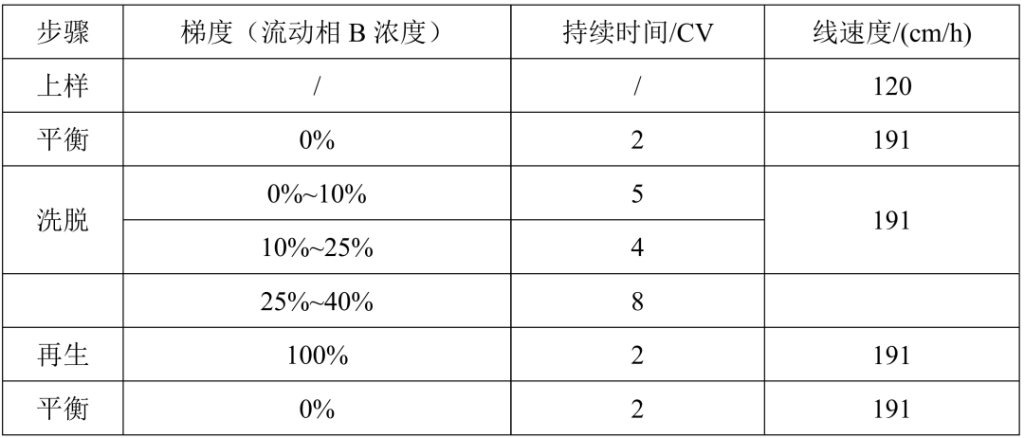
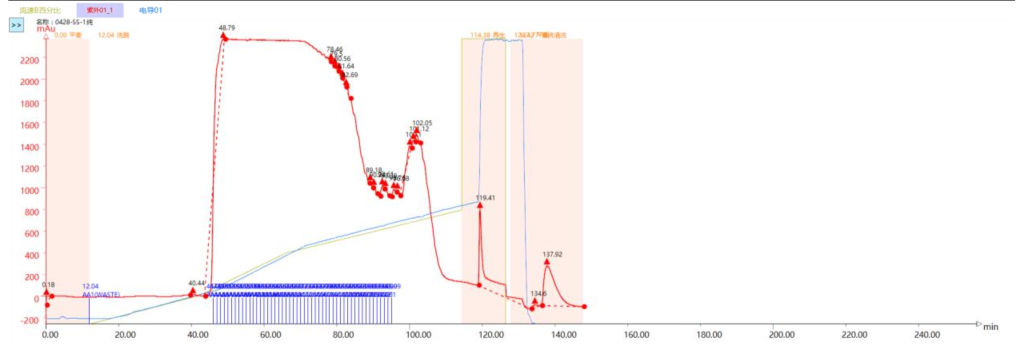
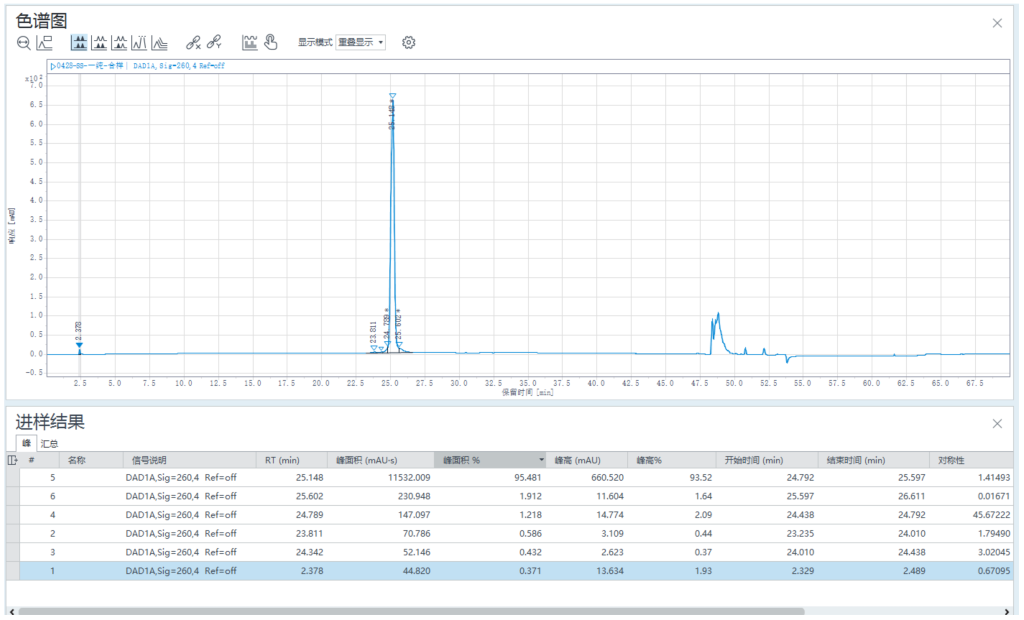
合样检测纯度 95.48%,纯化后样品收率:75.74%。
三样品3:英克司兰AS链反相纯化
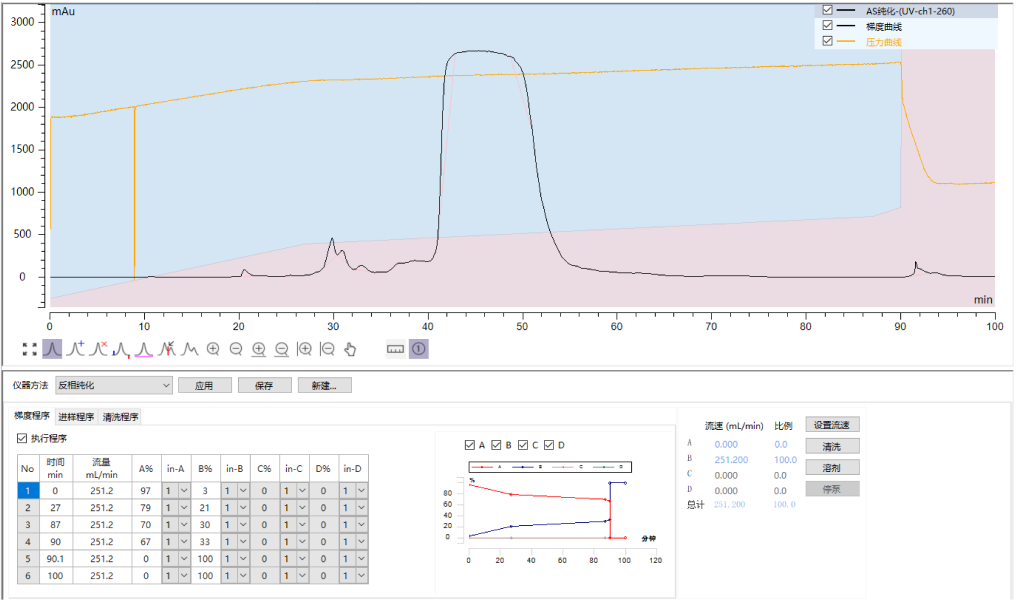
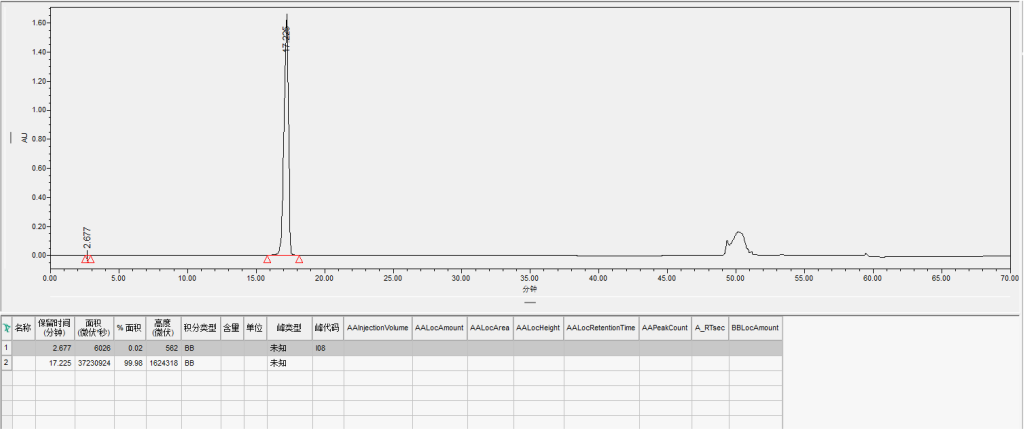
采用汉德科技HB-C18HAQ-100-30填料装填的制备柱,AS上样量2.08mg/ml,自检纯度99.98%,收率95.01%;
四样品4:英克司兰SS链反相纯化
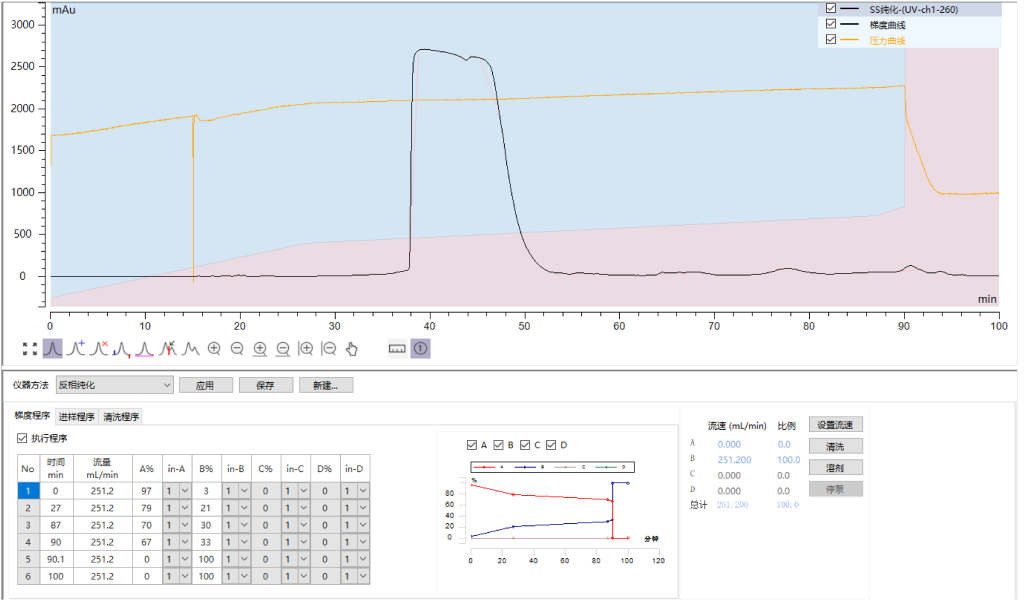
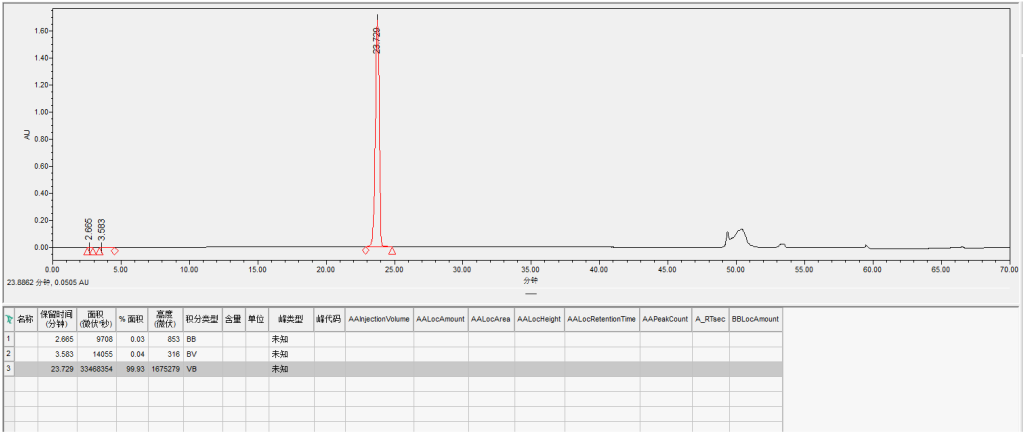
采用汉德科技HB-C18HAQ-100-30填料装填的制备柱,SS上样量2mg/ml,自检纯度99.93%,收率90.9%;
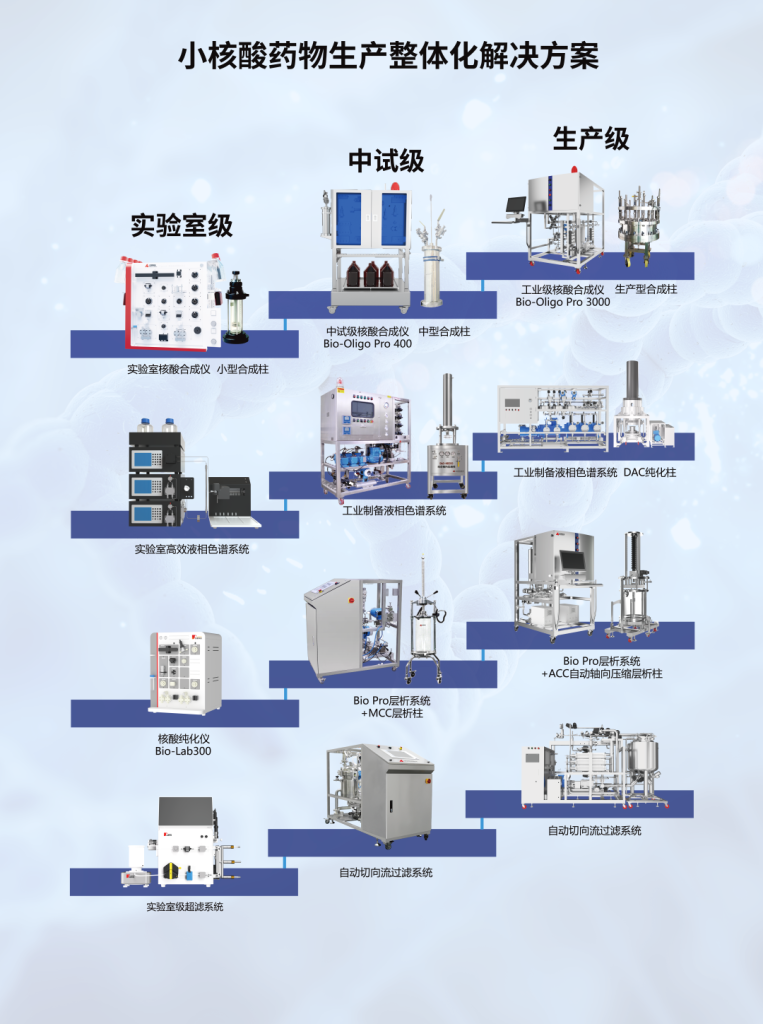
寡核苷酸药物整体解决方案
汉邦/汉凰科技为客户提供涵盖核酸合成系统、离子交换层析系统、反相制备液相色谱系统及切向流过滤系统在内的完整产品组合,全面支持从基础研究、工艺开发到规模化生产的各个环节。公司产品线可满足从实验室级别探索、中试工艺放大到工业级生产的全方位需求,凭借稳定可靠的系统性能和灵活可扩展的配置方案,为小核酸药物从早期研发到商业化生产全流程提供坚实的技术支撑与解决方案。