带状疱疹,俗称“缠腰蛇”或“生蛇”,是一种由水痘-带状疱疹病毒引发的、具有显著临床负担的病毒性疾病。该病毒在初次感染(通常表现为水痘)后,会潜伏于人体的感觉神经节中。当宿主免疫力下降(例如因年龄增长、疾病或应激等因素),潜伏的病毒可被重新激活,沿感觉神经扩散至皮肤,引发特征性的带状疱疹皮疹及剧烈的神经性疼痛。这种疼痛常被患者描述为极为剧烈,其程度在某些评估中可达到剧烈疼痛等级,甚至超过一些外科手术或分娩的痛感。尤为值得关注的是,约有5%-30%的患者在皮疹消退后仍会经历带状疱疹后遗神经痛,这是一种可能持续数月乃至数年的慢性疼痛状态,严重影响生活质量。
鉴于其显著的疾病负担,预防是至关重要的策略,而接种带状疱疹疫苗则被公认为最有效的预防手段。目前全球范围内已获批上市的带状疱疹疫苗主要包括两类技术路线:减毒活疫苗(Live Attenuated Vaccine, LAV)和基于中国仓鼠卵巢细胞(Chinese Hamster Ovary cell, CHO)的重组亚单位疫苗。
截至当前,全球共有四款带状疱疹疫苗获批上市:
葛兰素史克(GSK)的Shingrix:基于CHO细胞表达系统的重组亚单位疫苗;
百克生物的感维:减毒活疫苗;
默沙东(MSD)的 Zostavax:减毒活疫苗(部分市场已逐步退出);
SK化工株式会社的 Skyzoster:减毒活疫苗。
值得注意的是,2025年2月,绿竹生物自主研发的国内首款基于CHO细胞的重组带状疱疹疫苗新药上市申请(NDA)已获得中国国家药品监督管理局(NMPA)正式受理,这标志着国内重组带状疱疹疫苗研发取得重大进展。
从全球主要制药企业的研发管线布局以及现有上市产品的市场表现来看,基于CHO细胞的重组亚单位疫苗技术路线已成为当前带状疱疹疫苗研发的主导方向与核心焦点。 这类疫苗的核心抗原成分是病毒的糖蛋白E(gE)。作为在CHO细胞中重组表达的关键靶点,gE蛋白的等电点(pI)范围通常在4.5-6.2之间,分子量约为70-90 kDa。其高效的表达与高纯度的获取是保障疫苗安全性和有效性的基石。
因此,本文将聚焦于基于CHO细胞的重组带状疱疹疫苗(Recombinant Zoster Vaccine, RZV)的下游生产工艺,深入探讨其高效、稳定、规模化的纯化工艺解决方案。
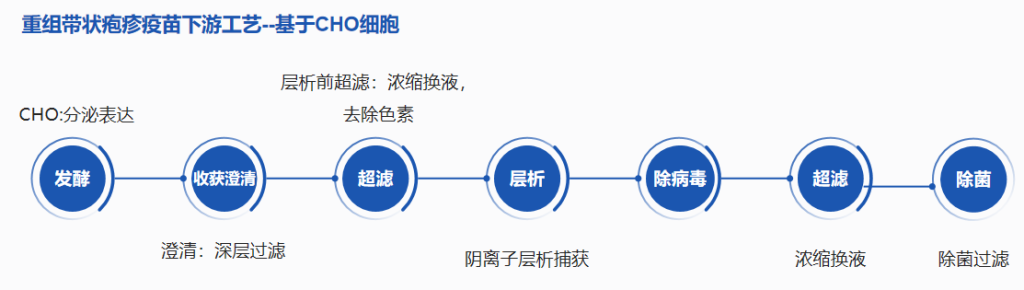
图1 重组带状疱疹疫苗下游工艺——基于CHO细胞
01深层过滤
重组带状疱疹疫苗的生产规模通常在500L以内。这一规模范围,尤其在临床样品生产和部分商业化生产的早期阶段,已被证明在工艺可控性、产品质量一致性以及成本效益方面具有良好的平衡性。初级收获液(Primary Harvest)的澄清是下游纯化流程的第一步,旨在高效去除培养液中的细胞碎片、不溶性杂质、胶体物质以及部分宿主细胞蛋白(HCP)和宿主细胞DNA(HCD),为后续的精纯步骤(如层析)提供清洁的上样料液。在这一关键步骤中,深层过滤(Depth Filtration)因其操作简便、通量高、载量可观且能有效去除细小颗粒,常被选为首选的澄清策略。汉邦科技可以提供不同规格型号的深层过滤设备,以满足不同的需求和应用。

图 2 深层过滤系统&夹具
02层析工艺
在基于CHO细胞的重组带状疱疹疫苗(RZV)的下游纯化工艺中,层析技术扮演着核心角色,其目标在于高效、高选择性地分离和纯化目标抗原——糖蛋白E(gE),同时最大限度地去除工艺相关杂质(如宿主细胞蛋白HCP、培养基成分、病毒/核酸片段、内毒素及聚集体等)。目前业界广泛采用并经过验证的典型层析策略通常包含以下三个关键步骤,形成一套串联的纯化流程:
01捕获阶段(Capture)
阴离子交换层析(AEX),主要进行初始捕获、浓缩与初级纯化。利用目标gE蛋白在特定缓冲液pH条件下(通常高于其等电点pI 4.5-6.2)带负电荷的特性。
02中度纯化阶段(Intermediate Purification)
采用复合模式层析/混合模式层(Mixed-Mode Chromatography, MMC),此步骤旨在进行深度纯化,重点解决难以通过单一模式层析去除的关键杂质,特别是与gE蛋白理化性质(如电荷、疏水性)相近的杂质(如某些HCP、聚集体、降解产物)。
03精纯阶段(Polishing)
实现最终的高纯度精制,确保产品满足严格的质量放行标准。此步骤主要清除残留的微量杂质、聚集体、工艺添加剂以及确保产物处于正确的分子形式。
汉邦科技系列低压层析产品能够适配从实验室规模工艺开发到中试乃至生产规模放大的需求,可为重组带状疱疹疫苗(RZV)的层析纯化工艺提供坚实的硬件保障,有效提升工艺的稳健性、效率及产品收率,是加速高质量RZV抗原生产不可或缺的强有力工具。

图 3 Bio-Pro 层析系统&ACC 自动轴向压缩层析相
03除病毒过滤
在重组带状疱疹疫苗(RZV)的生产工艺中,病毒清除/去除(Viral Clearance/Removal) 是保障产品安全性的关键步骤,通常作为下游纯化的最终环节之一。针对RZV抗原(gE蛋白)料液的典型特性——浓度较低(通常<10 g/L) 且处于生理中性pH范围(~7.0-7.5),其粘度低、胶体/颗粒负荷相对较小。基于这种料液情况,可以优先选择可以实现高载量和高通量的除病毒过滤器进行高效除病毒,同时最大限度地减少珍贵抗原的损失和处理时间。

图 4 除病毒过滤系统&夹具
04超滤
对于RZV疫苗的超滤,通常料液起始浓度较低(<10g/L)和终端浓缩浓度也较低,如果追求更高的回收率,可以优先选择改良纤维素材质超滤膜包进行超滤。汉邦科技生产的膜包夹具可以匹配市面上主流厂家的膜包。
在重组带状疱疹疫苗(RZV)的下游工艺中,超滤/洗滤(UF/DF)是关键的浓缩与换液步骤。针对RZV抗原(gE蛋白)料液的特点——起始浓度较低(通常<10 g/L) 且目标浓缩终点也相对较低(因高浓度下潜在的聚集风险),操作中需特别关注产物回收率和剪切敏感性。
汉邦科技提供的超滤膜包夹具系统,其设计具备优异的通用性,能够无缝兼容并适配市面上主流品牌(如Pall/ Millipore/Sartorius等)的各类规格超滤膜包,为RZV生产工艺提供灵活、可靠的UF/DF解决方案,确保工艺稳健性。

图 5 Bio-TFF 自动切向流过滤系统
结 语
综上所述,构建高效、稳健、可放大的下游纯化工艺是生产高质量重组带状疱疹疫苗(RZV)抗原(gE蛋白)的核心挑战。从深层过滤澄清、多步层析精制、关键除病毒过滤到超滤/洗滤的浓缩换液,每一环节的优化都至关重要。
汉邦科技针对RZV生产的特殊需求(如低浓度料液处理),提供了一系列关键工艺设备解决方案。其低压层析系统、深层过滤系统、高兼容性的超滤膜包夹具等产品,致力于解决下游工艺中的实际痛点,显著提升产物回收率、工艺效率和整体稳健性,可为加速RZV的本土化研发与商业化生产提供强有力的技术支撑,助力提升疫苗的可及性。