一、胶原蛋白行业概况
胶原(Collagen)一词源自古希腊,大约在1865年前后首次出现,它是人体含量最为丰富的蛋白质。胶原广泛分布于人体的多种结缔组织,例如皮肤、软骨、骨骼、肌腱、韧带、角膜、器官被膜以及硬脑膜等。在正常人体中,约90%的胶原集中在皮肤和骨骼中。
图 1 胶原蛋白结构示意图
作为一种新兴的生物材料,重组胶原蛋白凭借其卓越的生物相容性、较低的免疫原性以及精准可控的结构,在医疗、美容和功能性食品等多个领域展现出了巨大的应用潜力。随着基因工程、合成生物学以及发酵技术的持续发展,重组胶原蛋白的产能和质量都得到了显著提高,为其在多元化市场中的进一步推广筑牢了坚实的基础。
根据Grand View Research报告,2019年中国胶原蛋白的市场规模增长至9.83亿美元,约占全球市场的6.40%;而到2027年,中国胶原蛋白的市场规模预计将达到15.76亿美元,约占全球市场的6.96%,2016-2027年年平均复合增长率为6.54%,高于全球的5.42%的市场增速。
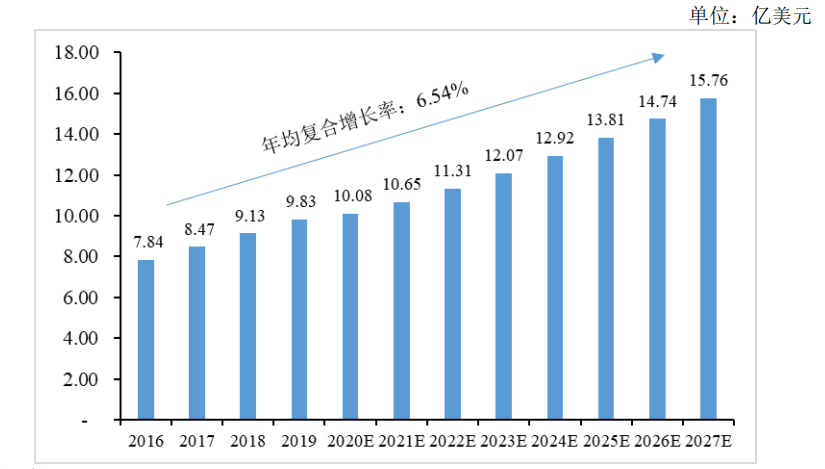
图2 2016-2027年胶原在全应用领域中国市场规模情况
数据来源:Grand View Research
二、重组胶原蛋白种类
胶原蛋白依据其结构和功能可以分为多种类型,主要包括Ⅰ型、Ⅱ型、Ⅲ型及Ⅴ型胶原蛋白等。
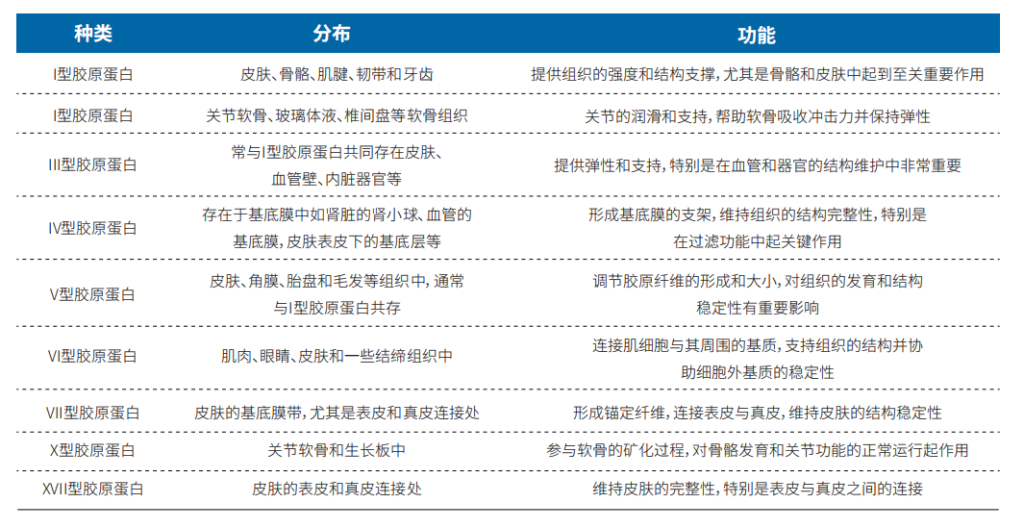
表1 主要类型的胶原蛋白
从来源角度分类,胶原蛋白主要分为两大类:动物源胶原蛋白和重组胶原蛋白。尽管植物来源的类似胶原蛋白物质近年来引起了关注,但严格意义上讲,植物并不含有真正的胶原蛋白。通过现代生物技术,可以从植物中提取与胶原蛋白相似的蛋白质和多肽。
当前市场上最为常见的胶原蛋白来源于动物,包括哺乳动物(如牛、猪)和海洋生物(如鱼)的皮肤、骨骼及软骨。牛源胶原蛋白因其富含Ⅰ型胶原蛋白而被广泛应用于皮肤护理和骨骼健康产品中。由于其结构与人类胶原蛋白高度相似且成本相对较低,猪源胶原蛋白在生物医用材料和保养品领域应用广泛。
另一方面,重组胶原蛋白是利用基因工程技术生产的一种新型胶原蛋白。该过程涉及将人类或其他物种的胶原蛋白基因插入微生物或动物细胞中,并通过发酵和提纯步骤获得产物。这种方法生产的胶原蛋白具有高纯度、结构可控、无致敏性和病原体风险等优点。此外,由于不依赖于动物来源,重组胶原蛋白被视为更加环保和可持续的选择。
随着重组胶原蛋白高纯度和精确可控性的优势逐渐显现,重组胶原蛋白正成为未来发展的关键方向。根据国家重组胶原蛋白生物材料命名指导原则,这类胶原蛋白进一步细分为重组人胶原蛋白、重组人源胶原蛋白和重组类胶原蛋白。
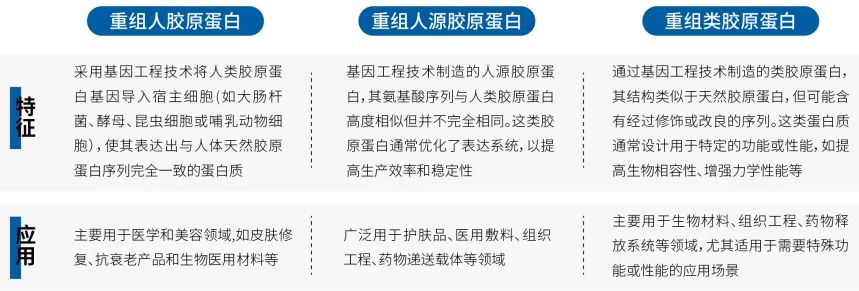
图3 重组胶原蛋白分类及应用
重组胶原蛋白在生物活性、生物相容性、低免疫原性、减少病原体漏检风险、水溶性以及无细胞毒性等方面,相较于传统动物来源的胶原蛋白展现出了显著的优势。
从安全性的角度来看,传统动物源胶原蛋白由于其蛋白质结构与人体存在差异,可能会引发免疫反应,从而带来一定的过敏风险。与此相反,重组胶原蛋白通过基因工程技术从细胞培养中提取,生产过程受到严格控制,能够有效避免病原体污染的风险。此外,传统动物提取方法受限于原料质量和提取工艺,难以确保纯度和质量的一致性。而重组胶原蛋白则可以通过精确控制氨基酸序列和三维结构,并利用发酵和纯化工艺实现大规模工业化生产,同时还能进一步加工和优化以满足不同需求。
值得注意的是,重组胶原蛋白的变性温度高达72℃,远高于动物源胶原蛋白的40℃,这使得它在运输和储存方面具有更大的优势。因此,无论是从安全性还是从实用性的角度考虑,重组胶原蛋白都展示了其超越传统动物来源胶原蛋白的卓越性能。这种新型胶原蛋白不仅提高了产品的稳定性和可靠性,同时也为用户提供了更安全的选择。
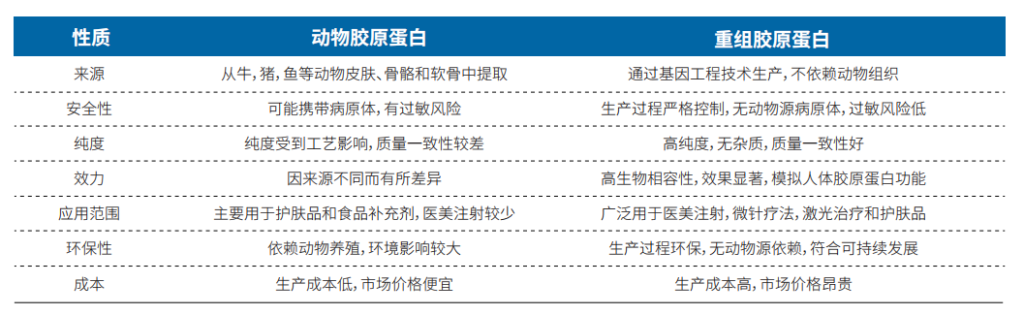
表2 动物源胶原蛋白与重组胶原蛋白多维度对比
随着胶原蛋白来源和生产技术的不断进步,重组胶原蛋白凭借其独特的优势,正逐渐成为医疗、美容等高要求领域的首选材料。未来,随着规模化生产的实现,重组胶原蛋白有望在更多领域中发挥重要作用,推动整个胶原蛋白产业朝着更安全、更高效、更可持续的方向发展。
三、重组胶原蛋白的生产
3.1 重组胶原蛋白产品的生产工艺流程
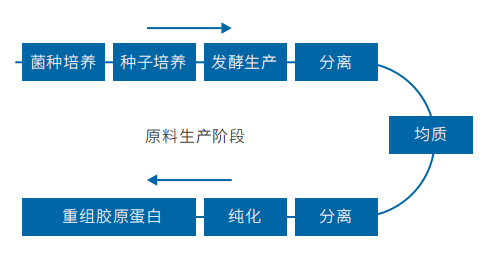
3.1.1重组胶原蛋白主要产品的通用生产工艺流程:
胶原蛋白依据其结构和功能可以分为多种类型,主要包括Ⅰ型、Ⅱ型、Ⅲ型及Ⅴ型胶原蛋白等。
3.1.2 重组Ⅲ型人源化胶原蛋白冻干纤维的生产工艺流程:
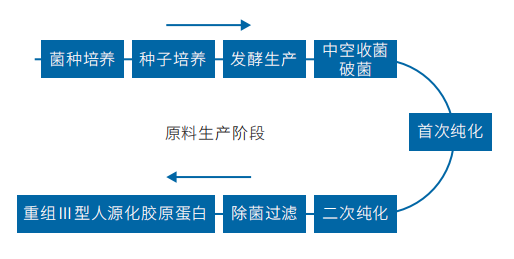
注:以上工艺仅供参考,具体生产以实际工艺为准
重组胶原蛋白产品的生产工艺流程是将基因工程技术与生物化学工艺相结合,以生产出高质量的胶原蛋白产品。整个过程始于选择合适的表达系统,常用的宿主细胞包括大肠杆菌、酵母菌等。首先,通过基因工程手段,将编码目标胶原蛋白的基因片段插入到载体中,并将其导入选定的宿主细胞内。随后,在优化后的发酵条件下培养这些转化细胞,使其大量表达目标蛋白质。
在成功完成发酵步骤后,需要进行细胞破碎和初步纯化,目的是释放并分离出所表达的胶原蛋白。这通常涉及到离心、过滤等方法以及亲和层析等手段来去除杂质,提纯目标产物。接下来的重要步骤是复性处理,旨在恢复胶原蛋白的天然三维结构,这对于保持其生物活性至关重要。
紧随发酵过程后的纯化步骤通常会产生多种杂质,包括宿主蛋白、核酸和内毒素等。在蛋白质经过蛋白酶酶解后,不仅会降解成多肽,还会生成多种氨基酸和小分子蛋白,形成复杂的混合物。这些杂质不仅会影响产品的纯度,还可能对最终产品的安全性和功能产生负面影响。
因此,优化纯化过程至关重要,不仅要有效去除杂质如宿主蛋白、核酸和内毒素,还要尽量保留目标蛋白质的完整性和活性。通过精细调整各纯化步骤,可以实现更高的纯度和回收率,确保最终产品的安全性和功能性符合高标准行业的要求。这种方法不仅能提升产品质量,还能增强生产效率,为广泛应用提供可靠保障。
为了获得高纯度、高活性和高产量的重组胶原蛋白样品,必须在深入了解其结构和性质的基础上,综合运用多种分离和纯化方法。一般步骤包括:首先使用盐析、等电点沉淀及超滤等技术去除大分子杂质,随后通过离子交换层析、凝胶过滤和高效液相色谱(HPLC)等技术进行逐级纯化,从而获得成分单一且活性较高的产品。
最终,经过严格的质检程序,包括纯度检测、功能性测试等,确保产品质量符合标准。值得注意的是,本文涉及的流程只是提供了一个基本框架,具体操作条件如发酵参数、纯化策略等应根据实际需求和产品应用领域进行适当调整。这种灵活性使得重组胶原蛋白能够在多种应用场景中发挥重要作用,例如医疗、化妆品等领域。通过不断优化生产工艺,可以进一步提高产品的产量和质量,满足市场需求。
四、汉邦科技分离纯化解决方案
重组胶原蛋白的纯化是生物制造链条中决定产品效能与临床应用价值的关键环节,其核心目标在于通过精密分离技术获取高纯度、高活性的功能性胶原蛋白。重组表达体系中宿主残留蛋白、核酸、内毒素等杂质的去除,可显著降低免疫原性风险,确保生物安全性符合医疗器械及药品监管标准。更重要的是,纯化工艺需精准保留胶原蛋白特有的三螺旋结构,该结构是支撑细胞黏附、促创面修复及诱导组织再生等生物功能的物质基础。
在医用领域,纯度不足可能导致材料力学性能下降或引发炎症反应,而过度纯化则易破坏天然构象,因此需通过多模态层析技术实现杂质靶向清除与活性结构协同保护。随着再生医学需求增长,高效纯化工艺的突破不仅能提升重组胶原蛋白的产业化转化效率,更能推动其在组织工程支架、药物缓释载体等高端领域的应用拓展,为生物材料创新提供关键技术支持。
下面以常规重组胶原蛋白的生产工艺流程为例,分享汉邦科技在重组胶原蛋白产品领域整体分离纯化解决方案。

分离纯化环节:

Bio-Lab 实验室层析系统

Bio-Pro层析系统&层析柱
离子交换层析:选择性去除宿主细胞残留蛋白(HCP)、核酸等杂质,利用目标蛋白与杂质的电荷差异实现初步纯化。
分子筛层析:按分子量分级分离,精准截留具有生物活性的三聚体胶原结构,剔除未正确折叠的单体或聚合体。
亲和层析:针对重组蛋白的特异性标签(如His标签),通过配体-受体结合机制实现高选择性富集,显著提升产物纯度。
除菌过滤:

实验室级自动切向流过滤系统

Bio-TFF 自动切向流过滤系统
深度杂质清除:采用纳米级过滤膜截留潜在病毒颗粒,结合特异性吸附树脂降低内毒素水平,确保生物安全性。
小结
重组胶原蛋白的研究始于对其分子结构的深入解析,经过几十年的发展,科学家们成功克隆了胶原蛋白基因,并在不同表达系统中进行了表达尝试。从早期的微生物系统到后来的哺乳动物和植物细胞系统,再到纯化工艺的显著提升,这些技术进展为重组胶原蛋白的产业化应用奠定了坚实基础。近年来,合成生物学的引入更是为重组胶原蛋白技术带来了革命性突破,提高了生产效率和纯度,拓宽了其应用领域。
在重组胶原蛋白的制备过程中,目的基因设计、表达体系构建、发酵以及纯化等环节均面临技术挑战。通过优化目的基因设计,科学家们成功提高了重组胶原蛋白的机械强度和稳定性,同时增强了其生物活性。在表达体系构建和发酵纯化环节,技术的不断迭代创新使得生产效率和产能得到了显著提升,成本也有望进一步降低。这些技术突破不仅解决了当前生产中的难题,还为未来更大规模的应用提供了可能。